Research
私たちは有機化学を基盤に様々なπ共役拡張化合物の合成に取り組んでいます.特に,
- 光変換前駆体法を利用した塗布型有機電子材料の開発
- 斬新な機能性π共役分子の構築
- アセンを用いた機能性材料の創成とナノカーボン材料への展開
- 新規骨格を有するポルフィリン類縁体の創出と機能発現
を柱に研究を展開しています。
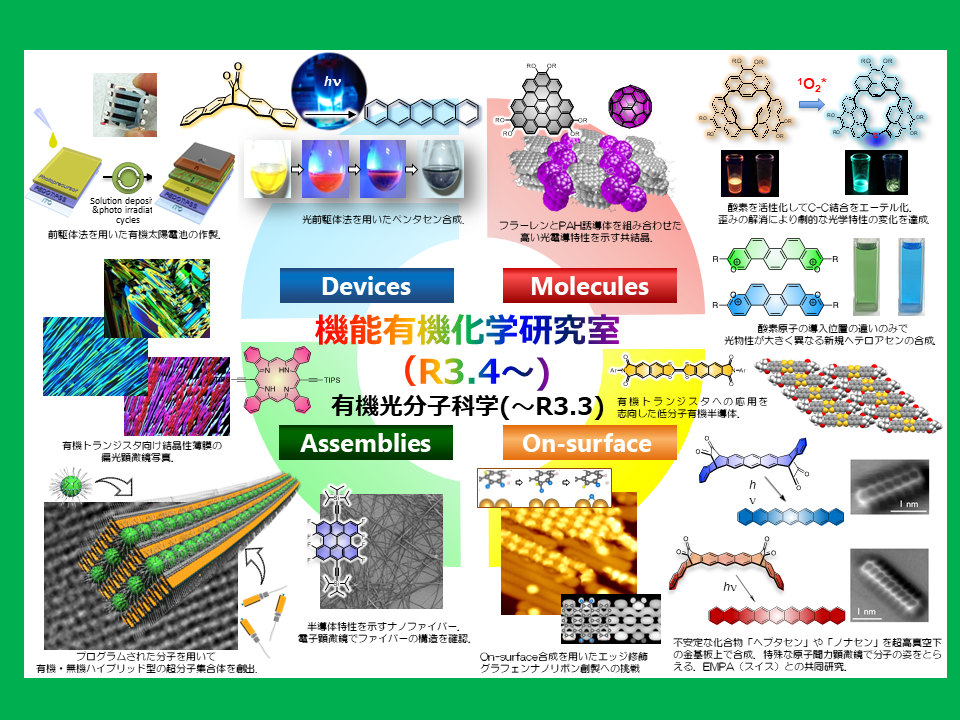
1. 光変換前駆体法を利用した塗布型有機電子材料の開発
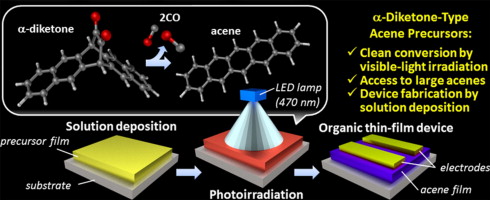
ペンタセン等の有機半導体を用いた有機薄膜太陽電池(OPV), 有機発光ダイオード(OLED), 有機電界効果トランジスタ(OTFT)は次世代のデバイスとして現在盛んに研究が行われています.ペンタセンなどのアセン類は一般的な有機溶媒に溶けにくいため,薄膜作製には真空蒸着を必要とします.しかし,低価格・大面積化・フレキシブルなどの利点により,真空蒸着を用いない溶液プロセスによる薄膜作製について注目が集まっています.低分子有機半導体の可溶化のために,我々は光変換前駆体法を用いています.ペンタセンのα-ジケトン型前駆体に可視光を照射するだけで,2分子のCOが脱離し,溶液中・薄膜中・結晶中で定量的にアセンに変換することができます(下の動画)[1-4].溶媒に可溶な前駆体を溶液プロセスで薄膜化した後,光照射して得られた有機半導体薄膜はOPVやOFETへ応用可能です.山形大学中山研究室との共同研究によりこの手法で作製したペンタセンOFETは0.86 cm2 V-1 s-1という高い電荷移動度を示しました[5].
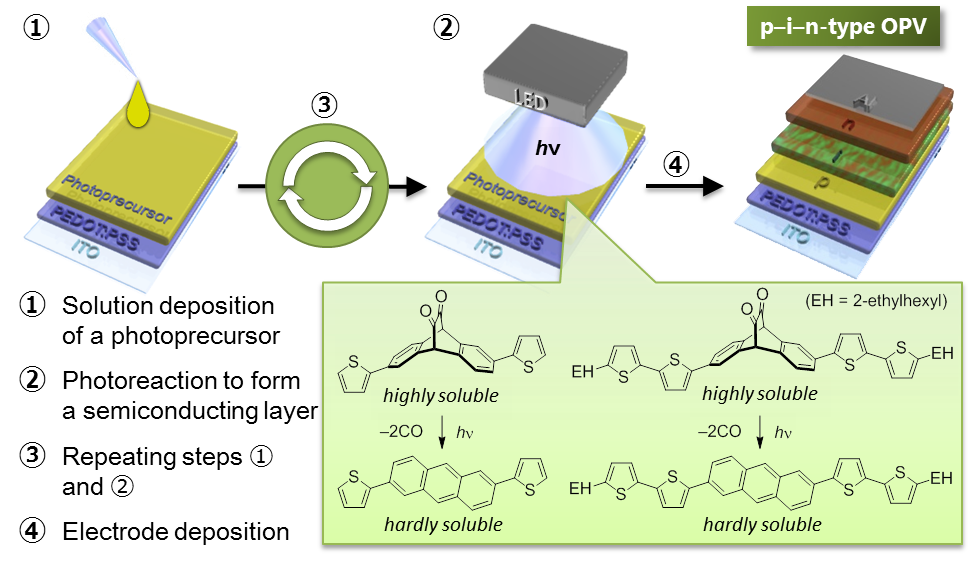
この手法を用いると溶液プロセスによる積層膜の作製が可能です.また光反応を利用して薄膜の結晶構造を制御することもできるので,溶液プロセスによる積層型有機薄膜太陽電池の薄膜構造制御に向けて,さまざまなアセン誘導体の合成に取り組んでいます[6-11].
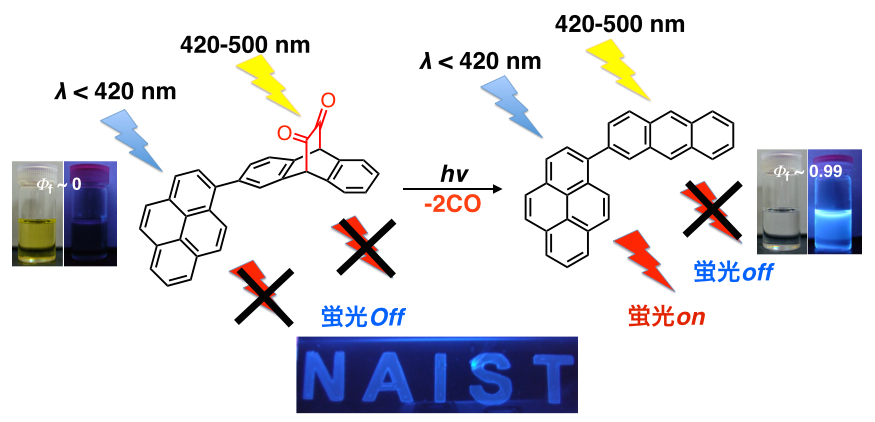
このジケトン前駆体は発光を消光させる作用があるため,光照射前後で発光強度を劇的に変化させることが可能です.そのため潜在性発光材料としての応用を展開しており,ジケトン前駆体を用いた光パターニングにも成功しています[12,13].
参考文献
[1] Tetrahedron Lett., 2005, 46, 1981-1983. [2] Chem. Eur. J., 2005, 11, 6212-6220. [3] Phys. Chem. Chem. Phys., 2014, 16, 13483-13488. [4] J. Photochem. Photobiol. C -Photochem. Rev., 2014, 15, 50-70. [5] J. Mater. Chem. C, 2013, 1, 6244-6251. [6] Chem. Commun., 2012, 48, 11136-11138. [7] Eur. J. Org. Chem., 2012, 1723-1729. [8] J. Mater. Chem. C, 2014, 2. 986-993. [9] Solar Eng. Mater. Solar Cells, 2013, 114, 156-160. [10] Chem. Commun., 2013, 49, 11638-11640. [11] Jpn. J. Appl. Phys., 2014, 53, 01AB02. [12] Tetrahedron Lett., 2013, 54, 1790-1793. [13] Chem. Commun., 2013, 49, 3661-3663.
2. 斬新な機能性π共役分子の構築
分子性グラフェン
分子性グラフェン・分子性グラフェンナノリボン・分子性カーボンナノチューブの設計指針と合成法を確立し,またその材料の特長を活かした素子の開発を目指しています.
分子性グラフェンとしてこれまで合成例のないペリペンタセンの合成に,テトラベンゾ体として世界で初めて単離に成功しました.単結晶構造では小さい骨格ながら既に「ナノグラファイト」様の重なり方を示しています[1].
直接結合型環状ピレン多量体
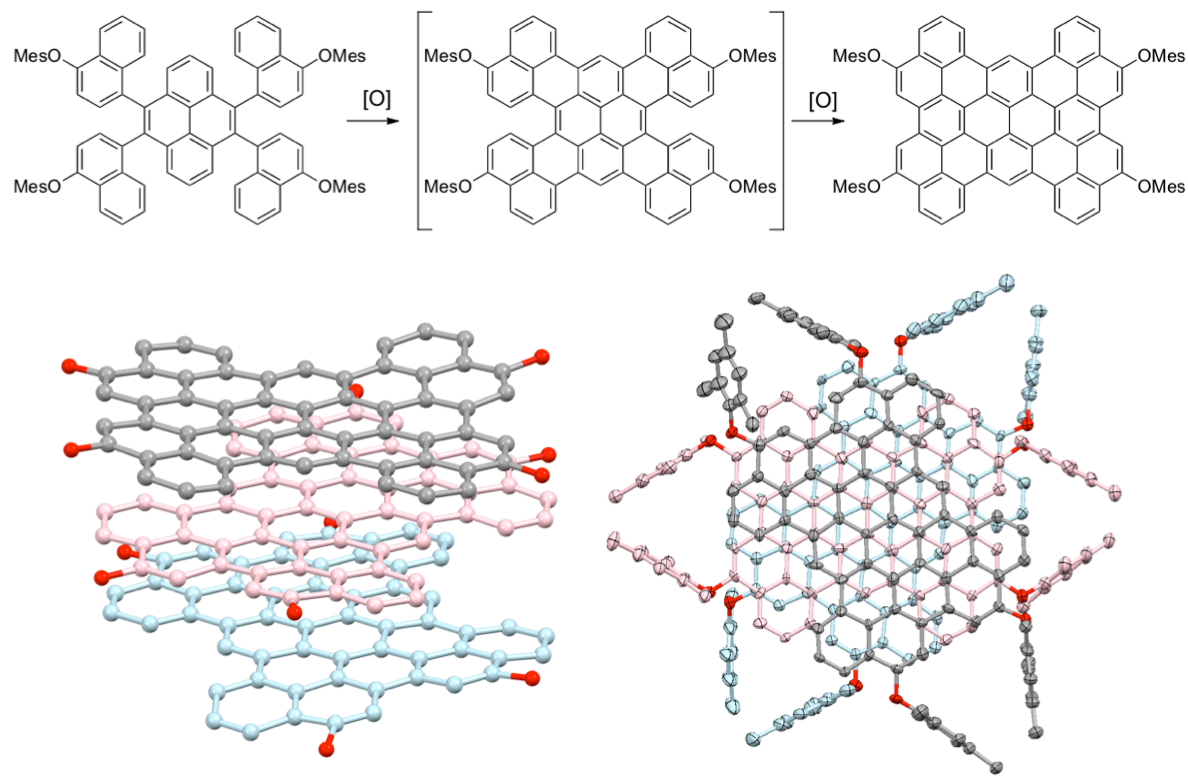
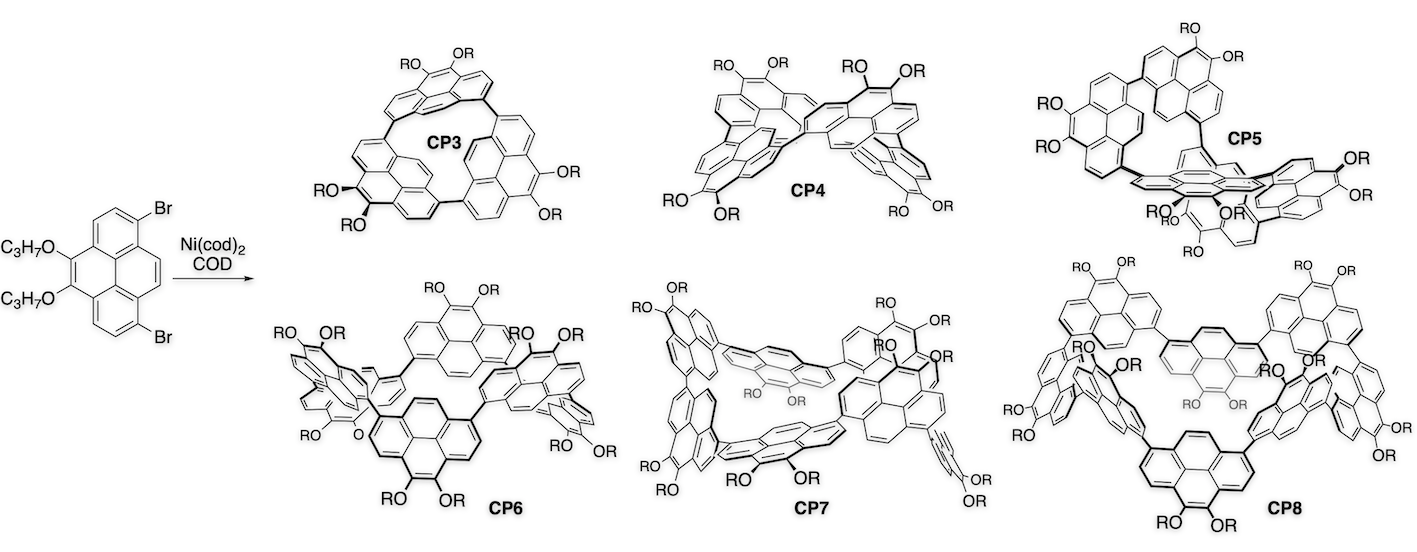
芳香族炭化水素で形成される大環状分子は、特異な構造をもつナノカーボンの部分構造であり、有機エレクトロニクス材料への応用も期待されている。 我々は、1,8-ジブロモピレンのNi(cod)2を用いたカップリング反応により、一連の直接結合型環状ピレン多量体CPnの生成を19量体まで確認し、3量体から8量体までを単離することに成功した[2-4]. このうち環状5量体CP5は、分子内に特別な結合や相互作用を導入していないにもかかわらず、不斉ねじれの立体配座をとっていることが明らかとなった。さらにCP5はキラルカラムHPLCによる光学分割にも成功し、円二色性スペクトル(CD)および円偏光発光スペクトル(CPL)のシグナルを観測した[2]. CP5は高い蛍光量子収率を有することから光デバイスへの応用が期待される.
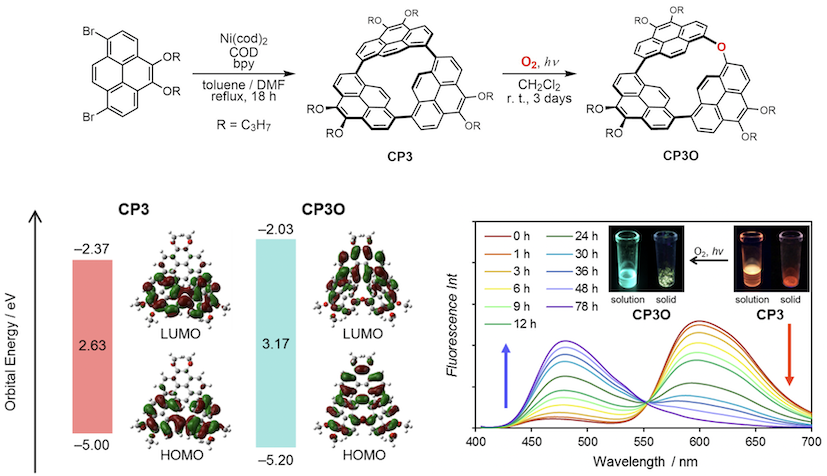
一方、CP3は単結晶X線構造解析により高度に歪んだ構造であることが明らかとなり、近接化によるピレン間の強力な電子的相互作用のため全ピレン系発光団の中で最も長波長である599 nmのオレンジ色発光を示した。さらに、この歪みエネルギーを駆動力として、室内光下で炭素–炭素σ結合間に酸素原子が挿入したCP3Oへ変換した。本反応は高歪み化合物を利用した1O2のセンシングおよび新しいエーテル合成法としても興味深い[4].
参考文献
[1] Angew. Chem. Int. Ed. 2015, 54, 8175; [2] Chem. Commun. 2019, 55, 9618; (Selected as an Inside Back Cover) [3] Chem. Lett. 2020, 49, 892; (Editor's chioce) [4] Chem. Sci. 2019, 10, 6785; (Selected as an Inside Back Cover)
3. アセンを用いた機能性材料の創成とナノカーボン材料への展開
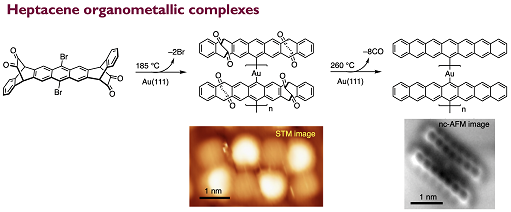
高次アセンはベンゼン環が直線上に連結した構造を有する最も単純な多環芳香族炭化水素です.高次アセンはアモルファスシリコンに匹敵する優れた電荷輸送特性を示すだけでなく,バンドギャップの狭いアームチェア型グラフェンナノリボン(GNR)合成の鍵化合物と成り得ます.また,最も幅の狭いジグザグ型GNRと見なすことができる高次アセンは,ジグザグ型GNRのエッジ状態や化学的反応性や電子的構造を理解するモデル系としての利用が期待されています.一方,通常高次アセンは難溶で不安定であり,構造・物性に関する報告が限られています.そこで我々は,「前駆体法」と「嫌気条件下での変換反応」を組み合わせることで,高次アセンの構造と物性の相関解明を目指しています.下記は、世界に先駆け作製に成功したヘプタセン–金複合体の一分子レベル観測です(Roman Fasel教授@Empaとの共同研究)[1].
アセンを連結させて縮環反応を行うとGNRを作製することができます.GNRは,幅やエッジ部位の修飾により物性を制御できるナノカーボン材料であり,次世代有機デバイスの基幹材料として期待されています.我々は富士通研と協力して,エッジ修飾GNRの作製や合成メカニズム解析を行なっています[2].またその過程において,エッジをフッ素化したGNR前駆体分子を用いることで,GNRが局所的に配向制御することを見出し,GNR-FETのon-currentを向上させることに成功しました[3].
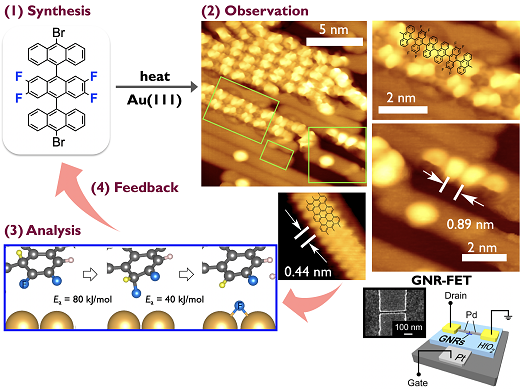
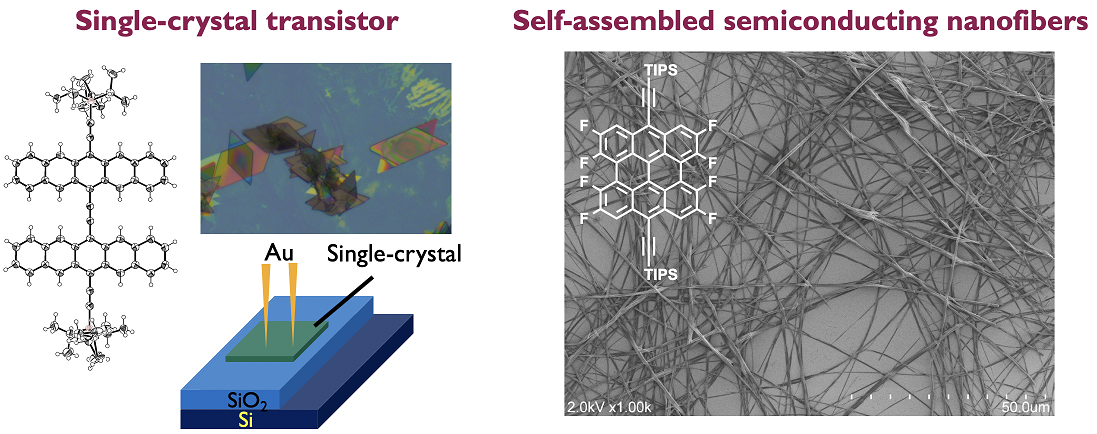
また、上記の研究で用いられているアセン化合物は,優れた電荷輸送特性や蛍光特性を示す化合物群です.我々は,アセン化合物の分子構造や付与する置換基を適切に設計・選択し,自己集合や自己組織化させることで,有機半導体材料としての機能向上を目指しています[4,5].
参考文献
[1] J. Am. Chem. Soc., 2017, 139, 11658-11661. [2] ACS Nano, 2017, 11, 6204-6210. [3] ACS Appl. Mater. Interfaces, 2018, 10, 31623-31630. [4] Chem.–Eur. J., 2017, 23, 7000-7008 (Selected as a HOT Paper and a Frontispiece). [5] Chem.–Eur. J., 2018, 9, 14913-14920.
4. 新規骨格を有するポルフィリン類縁体の創出と機能発現
ポルフィリン
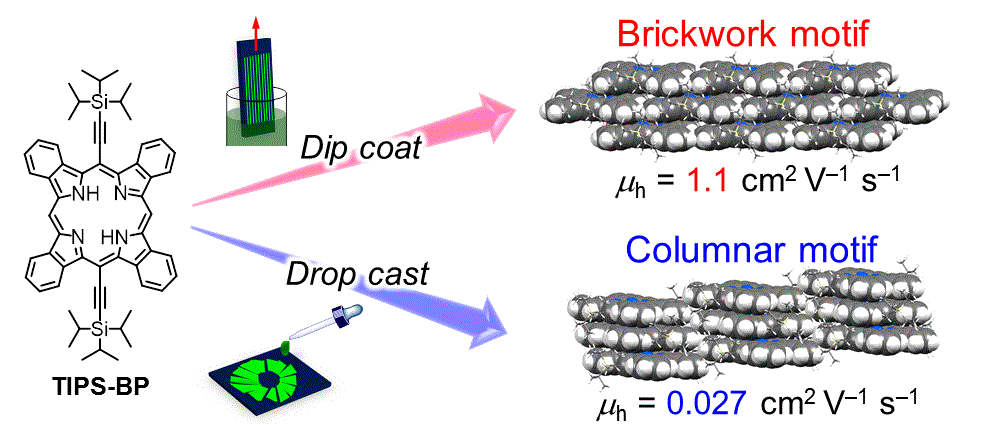
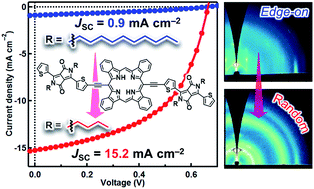
ベンゾポルフィリンは,優れた有機半導体材料として様々な有機デバイスへの応用が研究されています.我々は,結晶構造制御や光吸収効率の向上を目指したベンゾポルフィリン誘導体を合成し,有機トランジスタや有機薄膜太陽電池の活性材料として評価を行っています[1,2].
ポルフィセン
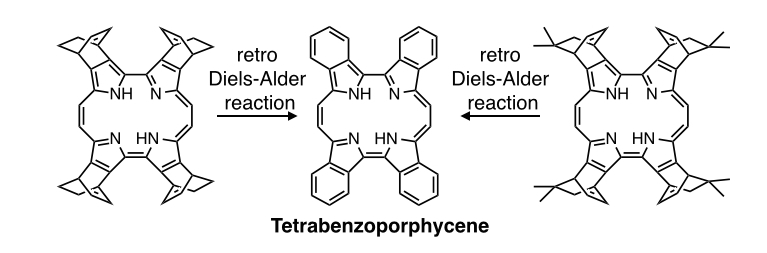
ポルフィセンはポルフィリンの構造異性体であり,可視領域に幅広く強い吸収帯を有し,美しい青色を呈します.この吸収特性や,分子内水素結合に起因する高い平面性から,有機トランジスタや有機薄膜太陽電池などの電子材料や近赤外発光材料への応用が期待されています.我々は,これまでの共役拡張ポルフィリンの合成の知見を活かして,様々な共役拡張ポルフィセンの合成を行い[3-5],ポルフィセン外部の構造によって蛍光特性や芳香族性を制御することに成功しています.また,神戸大石田研究室との共同研究により,熱変換前駆体法を利用した溶液プロセスによる薄膜構造制御と,有機薄膜太陽電池への応用にも取り組んでいます[6-8].
トリフィリン
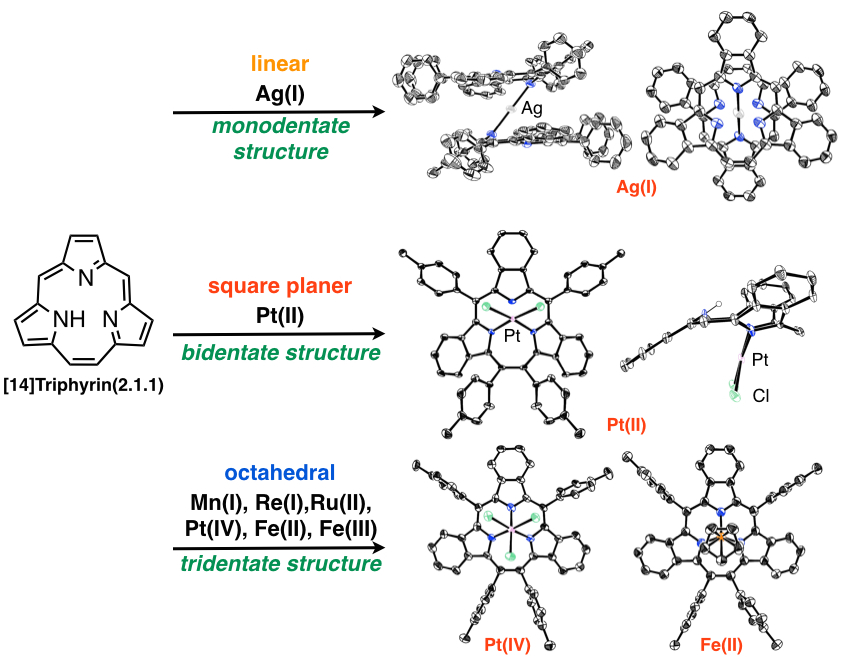
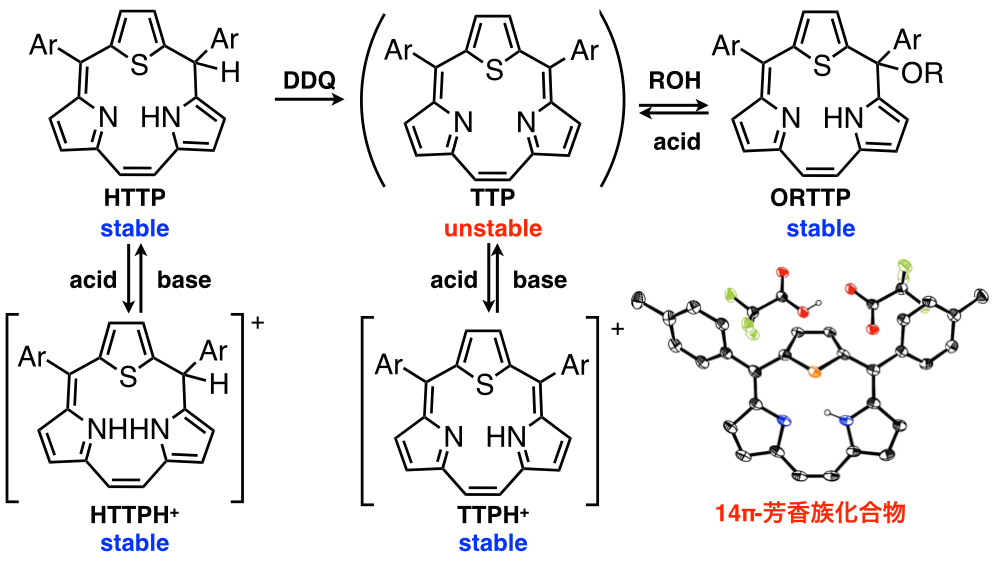
環縮小ポルフィリンは,ポルフィリンからピロール環が1つ欠落した構造です.この環のサイズの減少により,通常のポルフィリンとは異なる分光特性や配位構造を示すため,大変興味深い化合物です.我々は,ポルフィリンの一般的な合成法であるLindsey 法において,ポルフィリンだけではなくトリフィリンが得られることを初めて発見しました[9,10].また,McMurry法を用いた合成にも成功しています[11,12].このトリフィリンは14π芳香族化合物であり,一価三座の配位子として作用して様々な金属錯体を形成できます.現在,各種金属錯体の合成検討を行い,機能性分子や触媒への応用を見据えながら研究を行っています[13,14].また,核置換トリフィリンの合成など,様々な誘導体へと展開しています[15].
参考文献
[1] ACS Appl. Mater. Interfaces, 2017, 9, 8211-8218. [2] J. Mater. Chem. A, 2017, 5, 14003-14011. [3] Chem. Eur. J., 2009, 15, 10060-10069. [4] Chem. Eur. J., 2011, 17, 3376-3383. [5] Org. Lett., 2014, 16, 3508-3511. [6] Appl. Phys. Express., 2013, 6, 035601. [7] Jpn. J. Appl. Phys., 2013, 52, 111601. [8] J. Mater. Chem. C, 2014, 2, 5357-5364. [9] J. Am. Chem. Soc., 2008, 130, 16478-16479. [10] Chem. Eur. J., 2011, 17, 4396-4407. [11] Chem. Commun., 2011, 47, 722-724. [12] Heterocycles, 2013, 87, 1209-1240. [13] Inorg. Chem., 2013, 52, 1688-1690. [14] Angew. Chem. Int. Ed., 2013, 52, 7306-7309. [15] Angew. Chem. Int. Ed., 2013, 52, 3360-3363.






