研究紹介
光情報伝達機構の理解を目指したモデル系の構築
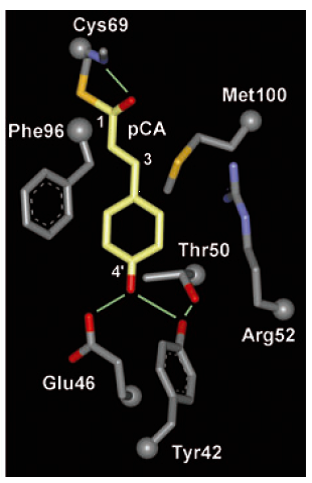
生物が光を利用する際には、光を受容する蛋白質を用いています。蛋白質を構成するアミノ酸残基はそのままでは、可視光を吸収することはできないため、これらの蛋白質は、視覚の光受容体レチナール等で知られる補欠因子、発色団を結合しています。このような、光受容蛋白質の中でも水溶性球状蛋白質として初めて単離されたものが、紅色光合成細菌Halorhodospira halophilaに存在する Photoactive Yellow Protein (Hh-PYP)で、鮮やかな黄色を呈した蛋白質です(写真)。発色団としてp-クマル酸がシステイン残基にチオエステル結合を介して結合していて(図1)、青色の光を吸収します。細菌はPYPを用いて青い光から逃れる光走性を示しますが、詳細な分子機構はいまだにわかっていません。水溶性で比較的小型なHh-PYPは、ロドプシン等の膜蛋白質に比べて、構造解析等を行いやすく、原子レベルから蛋白質光情報伝達機構を議論するのに最も適した蛋白質の一つと言えます。
 |
 |
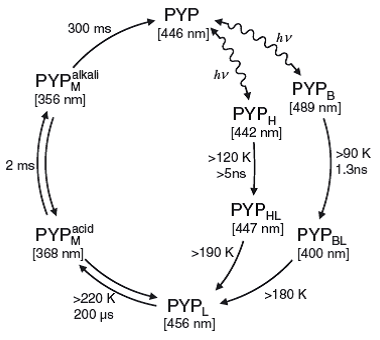 |
写真.Hh-PYP溶液 |
図1.Hh-PYPの発色団、p-クマル酸 |
図2.Hh-PYPの光反応サイクル |
Hh-PYPは発色団クマル酸を結合することで黄色を示し、吸収極大波長は446 nmになります。クマル酸だけでの吸収は紫外部に存在して、このような吸収波長を示さず、蛋白質の構造がこのような吸収極大波長を示すのに必要であることが分かります。PYPは光を吸収するとクマル酸の光異性化反応が引き起こされ、クマル酸の吸収極大波長の違ういくつかの中間体を経由してまた、元の状態に戻る光反応サイクルを示します(図2)。光反応サイクルは、1秒ほどで終わりますが、この過程で、蛋白質の構造変化が誘起され、光情報を伝達する相互作用が起こると考えられています(高次構造転移による情報伝達制御の項参照)。この反応過程における、吸収スペクトル変化と構造変化は、アミノ酸残基の配列に依存した精緻な構造によって実現されていて、1アミノ酸残基の置換や、部分的な欠損によって性質が大きく変化します。このような、蛋白質の構造や構造変化を最適に実現しているアミノ酸配列の基礎を見出し、光情報伝達の分子機構の解明を目指しています。
蛋白質機能の多様性を実現する分子機構
ゲノム解析の進展に伴い、様々な細菌種からPYPに相当する蛋白質が見出されてきています。PYPは細菌種によって、光に対する生理応答も様々なものが考えられており、同じPYPであっても多様な性質を獲得していると考えられます(図3)。また、PYPはより大きな蛋白質グループのPASドメインファミリーに属しています。PASドメイン蛋白質はヒトから細菌に至る全ての生物界に存在する蛋白質で、様々な局面で、多様な機能を担っています。その中でPASドメイン自身は、主に情報伝達に属するセンサー部位や、相互作用部位を形成しています。このような多様な性質が共通の構造基盤の上に実現される分子機構を解明することで、蛋白質機能の多様性の理解を目指しています。
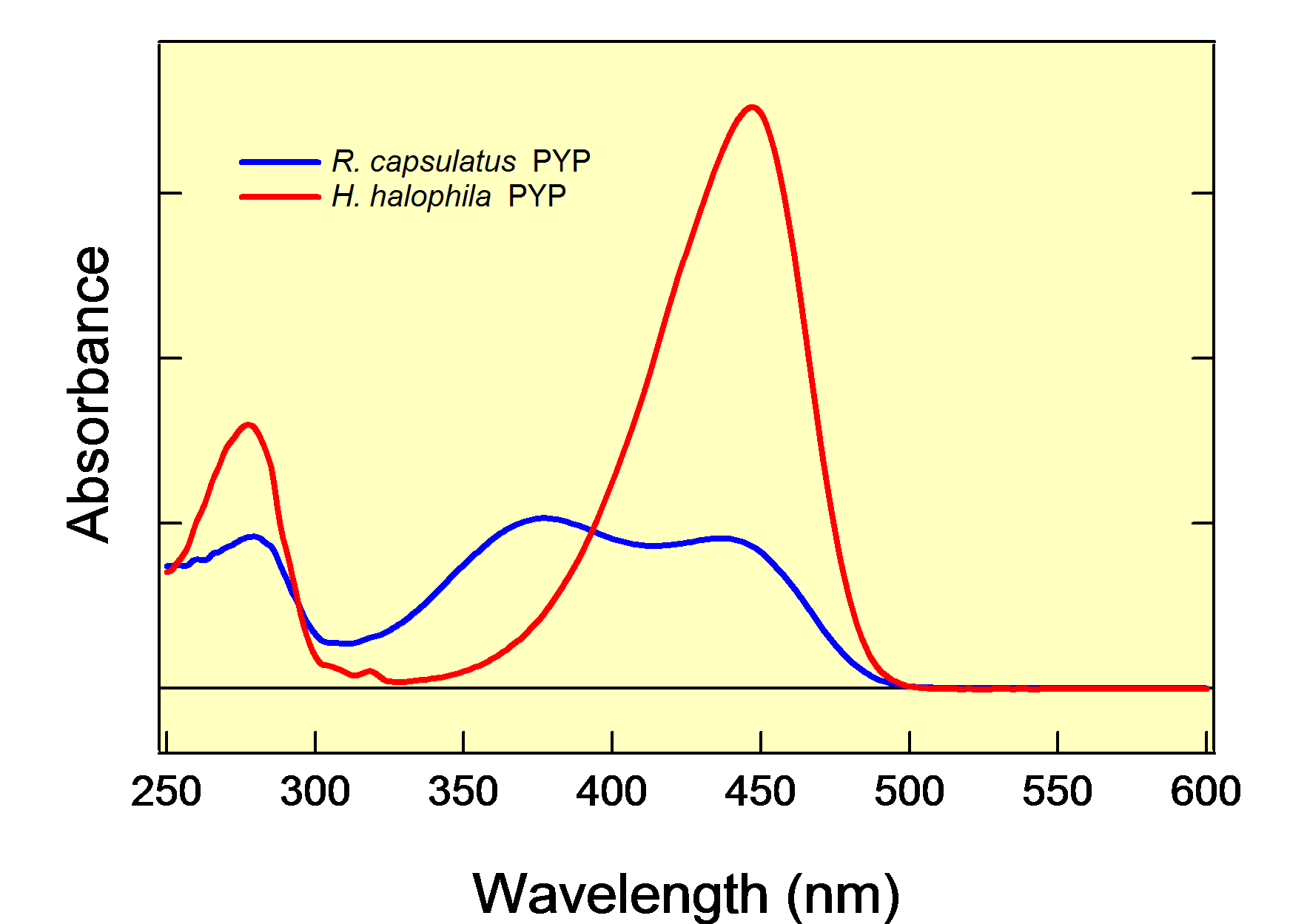 図3.異なる細菌種に見られるPYPの吸収スペクトルの違い |


