そして、個々の過程で登場する生体分子は、水素結合などの弱い相互作用を介して機能を発揮します。超分子化学は、生体分子の機能を化学の言葉で理解し、その知見を使ってユニークな機能分子を創成する技術を開発することを目的に生まれた学術分野です。
我々は、化学のあらゆる知見とテクニックで、生体分子の構造と機能の関係を解明し、その知見をもとに、新しい機能性生体分子を創成する研究を行っています。
「人工金属酵素(バイオ触媒)」、「外部刺激応答型機能」など、単なる生体分子の組み合わせるだけでなく、構造形成の先にある「機能」を狙うことに主眼を置いています。
また、生体機能関連反応から派生して、有機金属触媒、錯体化学反応の基礎的研究も並行して行い、化学・生化学全般にわたる融合的研究を進めています。
1 タンパク質と有機合成分子や錯体分子との複合化(ハイブリッド)による機能性生体分子の創成
多くのタンパク質は、L体アミノ酸を基本単位として、α‐ヘリックス、β‐シートといった高次構造により、特異的な反応場を提供しています。たとえば、化学反応を触媒するタンパク質である「酵素」は、活性部位で、触媒機構に関与する官能基が最適な位置に配置されることで、効率的かつ基質選択的な反応性を示します。一方で、生体内のタンパク質・酵素の多くは、金属イオンやヘムなどの有機分子を保持することで、固有の機能を発揮しており、タンパク質と有機分子のコラボレーションは生命機能をつかさどる源です。したがって、「タンパク質」そのものだけなく、タンパク質に組み入れる有機分子の設計・合成も、新しい生体分子を創成する上で有用な戦略です。
当グループでは、有機・錯体合成化学、遺伝子工学、タンパク質工学それぞれの利点を活用して、天然にはない機能をもつ生体分子の開発を行い、化学的方法だけ、あるいは、生化学的方法だけでは実現できない、ユニークな機能性生体分子の創成研究を行っています。
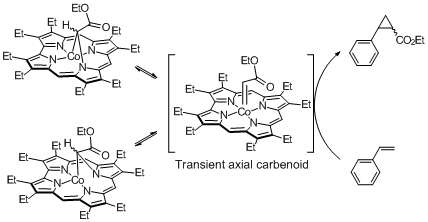
(1−1)有機金属錯体とタンパク質を組み合わせた「オレフィンメタセシス人工金属酵素」の創成
酵素を使った有機合成反応は長い歴史がありますが、酵素反応による物質変換の多くは、「酸化・還元・加水分解」といった生体内の代謝に関係する化学反応タイプです。
一方、工業化学・創薬・実験室での有機合成で大事な化学反応タイプである「炭素ー炭素結合の生成/切断」は、生体内の反応ではマイナーであるため、天然酵素による物質変換は困難です。
そこで、有用となる戦略は、、触媒活性点を合成分子に担わせ、その触媒中心をタンパク質の空間内に配置させる「複合分子(ハイブリッド)触媒」の構築です。
我々は、炭素−炭素二重結合の組み換え反応である「オレフィンメタセシス」を標的反応として、位置選択的にタンパク質に導入できるルテニウム錯体(Hoveyda-Grubbs型錯体)を開発し、これをタンパク質にコンジュゲートした「オレフィンメタセシス人工金属触媒」を開発しました。この触媒は、天然酵素では実現不可能なオレフィン同士の組み換え反応をタンパク質空間で進行させることができ、タンパク質の表面電荷による基質特異性も実現できています。
【代表論文】Chem. Commun. 2012, 48, 1662; Bioorg. Med. Chem. 2014,22, 5638;Tetrahedron Lett. (digest article) 2019, 60, 151226


(1−2)構造柔軟なタンパク質土台とする「機能スイッチング生体分子機械」の創成: タンパク質をベースとした「分子情報変換システム」
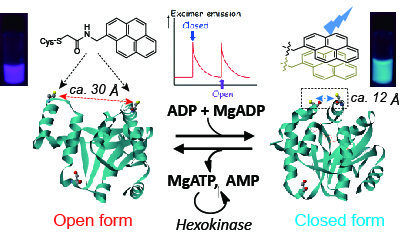
超分子化学研究の黎明期に、カテナン、ロタキサンのような「構造変化を伴って機能を発揮する超分子:分子機械」が多く合成されました。タンパク質の中にも、小分子結合などの外部刺激で大きく構造を変化させて機能を発揮する「ぐにゃぐにゃなタンパク質」があり、ATP/AMP/ADP間でリン酸基転移を触媒するアデニル酸キナーゼはその一例です。このようなタンパク質の動きは、数十オングストローム(数ナノメートル)スケールで動き、合成分子の動きよりもはるかに大きい変化です。したがって、このようなタンパク質を土台として、合成分子と組み合わせることで、合成分子だけでは達成できない「大きな構造変化を伴う分子機械」を創成することができます。
当グループでは、このような柔軟性の高いタンパク質と発光特性や磁気的特性を示す合成分子を組み合わせて、合成分子同士の相乗効果をオン・オフできる「外部刺激応答型生体分子機械」の構築を行っています。この分子機械は、「基質結合」という分子情報(「入力情報」)を発光特性や磁気特性という別の形の分子情報(「出力情報」)に変換する「分子情報変換素子」として機能する超分子です。
【主要論文】Bioconjugate Chem. 2013, 24, 1218; Bioconjugate Chem. 2015, 26, 537.
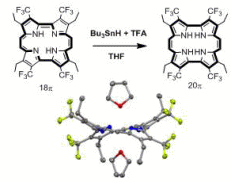
2 配位子の構造最適化による有機金属錯体触媒の開発
上記に示した「オレフィンメタセシス人工金属酵素の研究」から派生して、オレフィンメタセシス反応を生化学実験のツールとして使う「新しい実験法」の開発をめざして研究をしています。
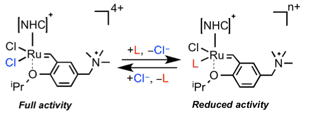
たとえば、配位子上にカチオン性官能基を導入したHoveyda-Grubbs型錯体は高い水溶性を示しますが、水中では触媒の分解が起こりやすくなります。我々は、「中性水溶液中で塩化物塩を添加する」方法で、水中で安定に触媒活性を保持させることができることを示しました。この方法は、非常にシンプルで多くの研究グループの研究に利用されています。現在、オレフィンメタセシスの「高いオレフィン選択性」を生体分子化学修飾の方法として利用する分子技術の開発を行っています。
【代表論文】Organometallics 2013, 32, 531; Catalysts. 2021,11, 359.; 有機合成化学協会誌2021年4月号
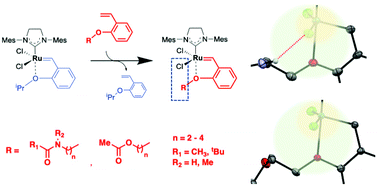
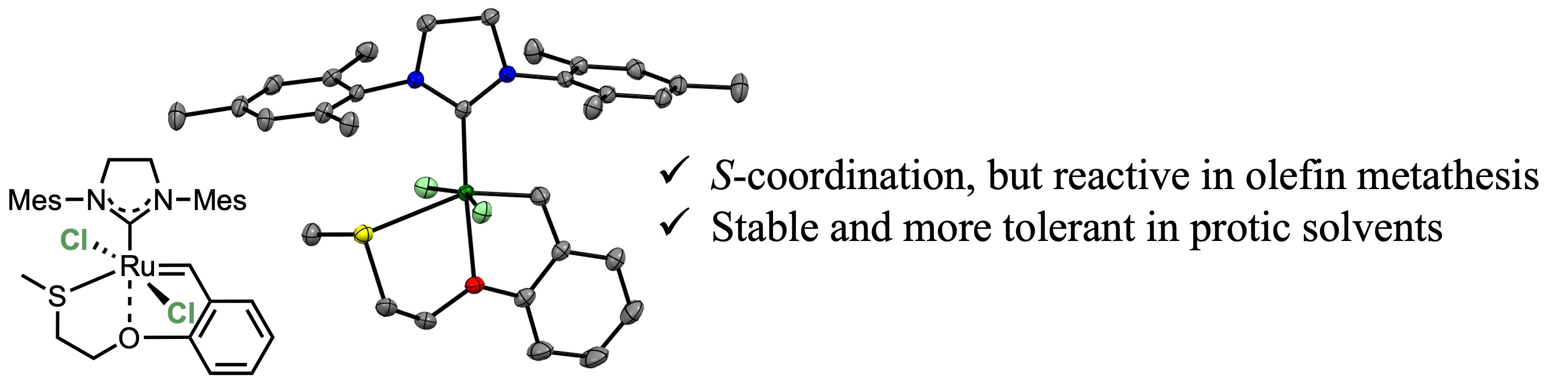
また、Hoveyda-Grubbs型錯体のベンジリデン配位子末端の構造修飾を行い、「第2配位圏効果」によって触媒活性を制御可能であることを実証しています。この知見を使って、生体分子上への「ルテニウム錯体移動反応」というユニークな有機金属反応も開発しています。さらに、硫黄原子のようなカルコゲン元素の導入によって、極性溶媒中で市販の触媒よりも耐久性が高くなることを見出しています。
【代表論文】Daltron Trans. 2020, 49, 11618; Chem. Lett. 2020, 49, 1490; Daltron Trans. 2023, 52, 9499
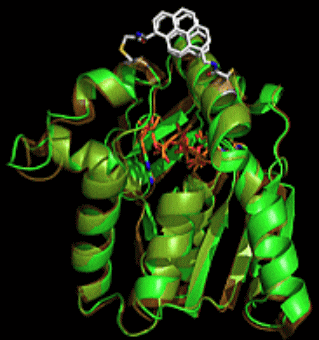
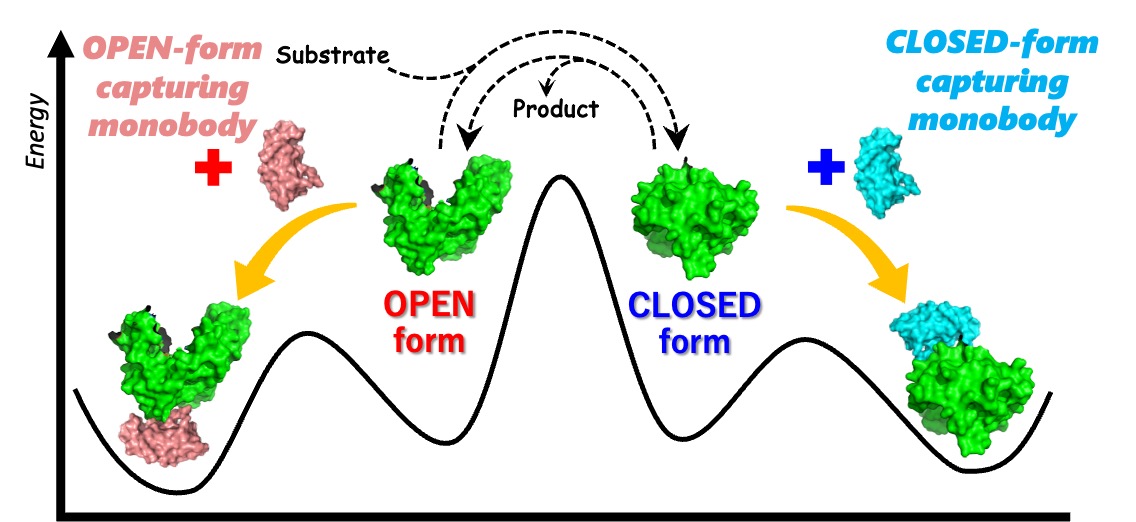
3 人工結合タンパク質(モノボディ)を用いたキナーゼ活性制御法の開発
上記に示した分子機械の創成に関する研究から派生して、低分子ながら抗体のような働きをする人工結合タンパク質(モノボディ monobody)を用いたキナーゼ活性制御法の開発をしています。
当グループでは、京都府立大の研究グループと共同で、アデニル酸キナーゼのOPENおよびCLOSEDの構造それぞれの状態を選択的に認識して結合するモノボディを創成し、キナーゼ活性制御の機構を、酵素活性測定、各種分光学を駆使して検証しています。大きな構造変化によって機能を示す酵素に対して、ある構造を捕捉するモノボディを使った「構造トラップ法」による機能制御を提案しました。
【代表論文】Protein Sci.. 2023, 32, e4813.
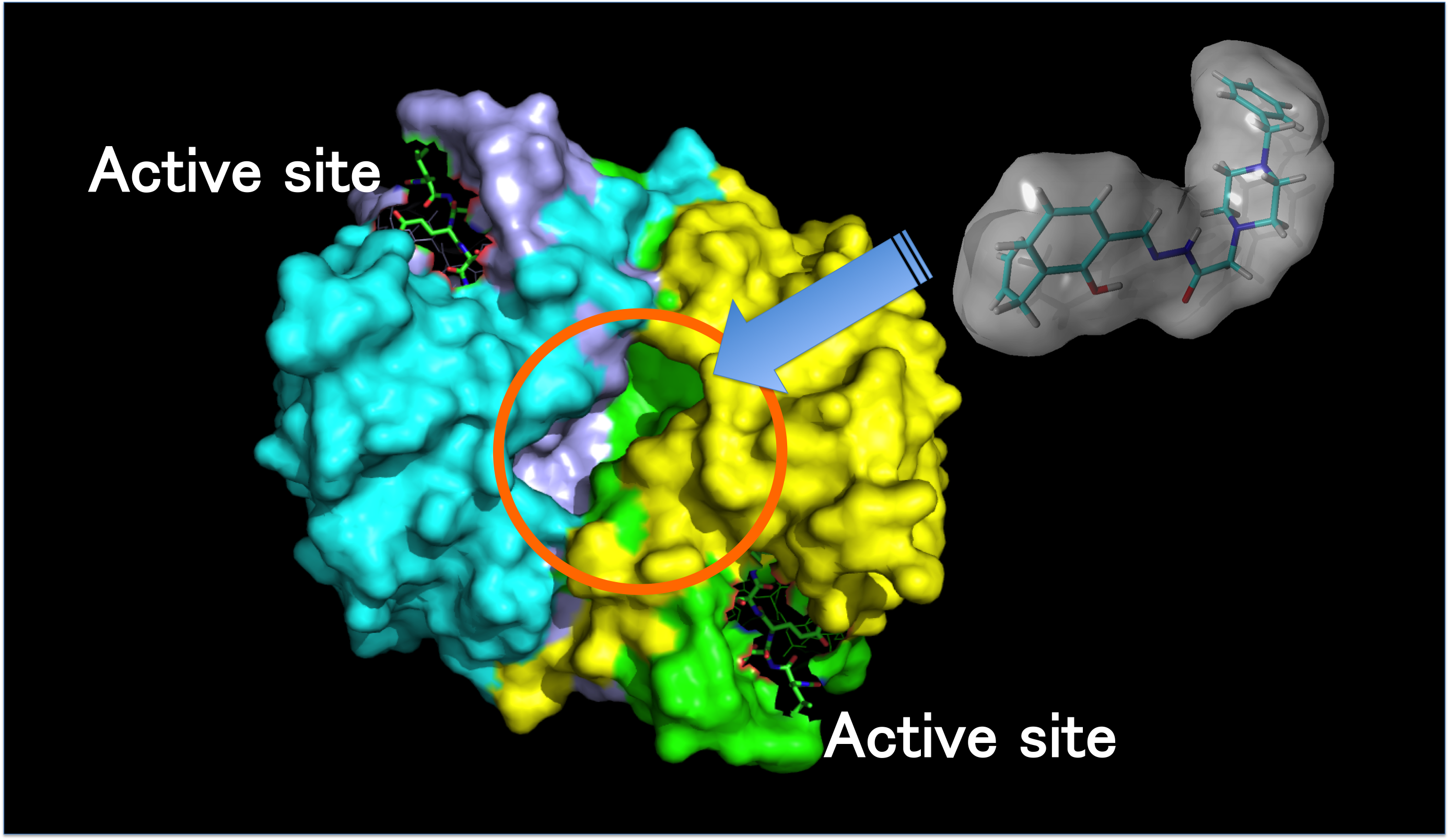
4. 有機小分子によるカスパーゼ3の機能制御
メディシナルケミストリーの観点から、アポトーシスやアミロイド生成などの生体反応を、有機小分子により人為的にコントロールする方法が重要な研究対象となっており、数々の生理活性小分子が報告されています。生理活性小分子の作用機構を正しく理解することは、臨床応用へ展開する際に欠かせません。
我々は、アポトーシスの実行を担う酵素であるカスパーゼ3の活性化を制御する有機小分子PAC-1は、ガン細胞のアポトーシスを誘導する分子として注目されており、金属イオンキレートによる作用機構が提唱されていました。一方、我々は最近、PAC-1が酵素分子に直接相互作用し機能をコントロールするという新たな作用機構を発見しました。この知見は、より効率的かつガン細胞選択的に作用する有機分子の開発につながります。
【主要論文】Bull. Chem. Soc. Jpn. 2015, 88, 1221.(BCSJ award article)


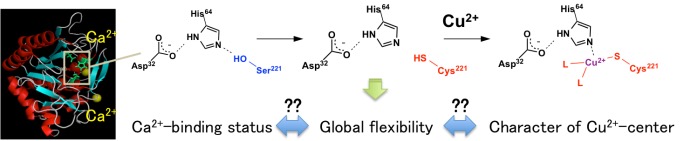
5. タンパク質に結合した金属イオンの反応性に対する生体高分子の「柔軟性」効果の検証
タンパク質に結合している金属イオンは、その結合状態(配位元素、配位構造)により、性質が巧みコントロールされていると考えられています。しかし、たった1個ないし数個の金属イオンをコントロールするのに、なぜ、分子量数万の巨大なタンパク質構造が必要なのか? このことは、タンパク質という分子の性質を理解する上で根本的な問題です。最近、我々は、低分子化合物による「モデル化合物」でなく、シンプルな構造のチオールサブチリシンを「モデルタンパク質」として用いて金属タンパク質の反応性制御メカニズムの検証を行い、アミノ酸ポリマーとしてのタンパク質構造柔軟性が、小さな金属イオンの性質を決める一要因であることを実験的に証明しました。このことは、化学的アプローチで、新たな機能性金属タンパク質を構築する際に、単に活性部位構造の最適化のみならず、生体高分子ポリマーとしての性質を使うことも一方法であることを示しています。
【主要論文】Chem. Eur. J. 2018, 24, 2767.
<生体分子の研究のほかに。。。>